A cultura celular passou a ser uma técnica essencial para as ciências biológicas.
Essa técnica passou por expansão devido à necessidade de melhor mimetizar o que ocorre num organismo e, com isso, entendeu-se a necessidade de estudar o papel do ambiente extracelular na regulação do comportamento das células em um ambiente in vitro e, dessa forma, surgiu a cultura tridimensional ou cultura de células 3D. Estes são sistemas de cultura que imitam melhor o meio biológico e são necessários para preencher algumas lacunas existentes entre culturas celulares convencionais e ambientes in vivo complexos.
Na cultura de células tridimensionais, as células interagem em três dimensões, o que resultou na criação de modelos mais preditivos para as mais variadas aplicações, como descobertas de novos fármacos, pesquisa oncológica, neurociências, entre outras. Os modelos de cultura celular tridimensionais podem ser de dois tipos:
1-Cultura celular tridimensional baseada em estrutura polimérica (hidrogel)
Nesta técnica de cultura celular, as células são sustentadas por uma estrutura polimérica conhecida como hidrogel. São redes hidrofílicas que podem conter aproximadamente 90% de água e também componentes da matriz extracelular. As células ficam imersas em hidrogéis para simular a matriz extracelular em um tecido in vivo.
2- Cultura celular tridimensional sem estrutura polimérica
Nesta técnica de cultura celular, as células são cultivadas sem a estrutura de suporte, dessa forma elas formam agregados tridimensionais, os esferóides, que por sua vez secretam a matriz extracelular a fim de se tornarem mais parecidos com os tecidos nativos.
O tipo de técnica utilizada vai depender principalmente da natureza das células, das finalidades e objetivos da cultura tridimensional. Essas técnicas permitem aos pesquisadores modelos com maior relevância biológica e com menor preocupação ética acelerando o avanço científico.
Nesse contexto, vários materiais foram desenvolvidos, particularmente hidrogéis, para atender a essa técnica aplicada nas diversas áreas. Mas a metodologia para desenvolver a técnica é de extrema importância para se ter um experimento confiável e reprodutível. Um dos principais cuidados que se deve ter é o de uma pipetagem adequada, uma vez que tratam-se de substâncias viscosas e células sensíveis. Para ísso, é essencial trabalhar com instrumentos adequados e de qualidade e as pipetas Picus® Nxt são ideais para a preparação de hidrogéis. Sabe-se que uma pipetagem imprecisa causa baixa reprodutibilidade entre amostras e experimentos e a preparação de culturas de células 3D é propensa a variabilidade devido aos hidrogéis, tipos de pipetas e ponteiras usadas no processo. Com as pipetas eletrônicas Picus® Nxt e hidrogel GrowDex® você obtem resultados muito mais reprodutíveis e confiáveis.
O menor coeficiente de variação (CV%) entre as réplicas foi alcançado ao preparar e pipetar utilizando a Picus® Nxt, como observado no gráfico, na Figura 1 abaixo: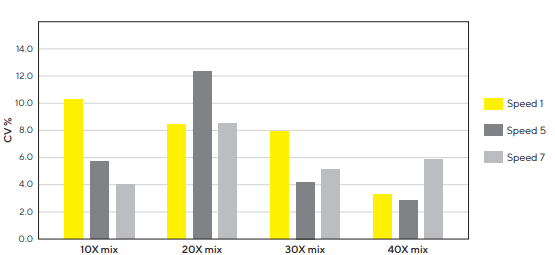
Figura 1: A velocidade média de pipetagem e várias etapas de mistura geram resultados de cultura de células 3D reproduzíveis. GrowDex® (concentração de estoque 1,5%) foi diluído para uma concentração de trabalho de 0,4% misturando-o com meio FBS-RPMI a 10%. As diluições foram preparadas misturando 10, 20, 30 ou 40 vezes, aplicando diferentes velocidades de aspiração e dispensação (1, 5 ou 7) na pipeta Picus® Nxt 1000. As misturas foram pipetadas para placas de 96 poços (100 µL em modo de distribuição múltipla, ajuste de velocidade 7, n = 12). O conteúdo de GrowDex® em cada poço foi quantificado com um ensaio de fluorescência. O CV% foi calculado para cada condição de mistura separadamente.
Quando a mistura é feita de forma inadequada e ocorre a formação de bolhas e espuma tem-se uma alta variação no número de células e diminuição da viabilidade celular, como observado na Figura 2.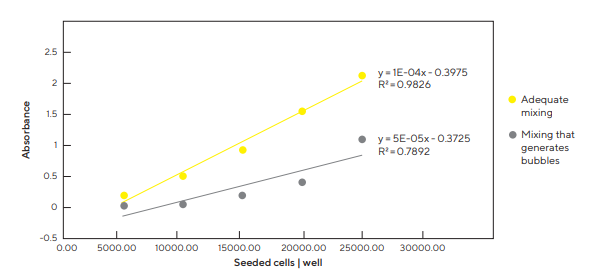
Figura 2: A mistura adequada aumenta a reprodutibilidade da semeadura de células, enquanto a mistura não adequada diminui a reprodutibilidade e a viabilidade das células. Diferente número de células foi semeado por poço em placas de 96 poços após misturar células com meio de cultura usando uma pipeta Picus® Nxt. As células viáveis foram quantificadas com um ensaio baseado em formazan. A mistura adequada gerou resultados reprodutíveis e alta viabilidade celular. Por outro lado, a mistura que gerou bolhas aumentou a variação no número de células e diminuíram a viabilidade celular. Dados mostrados de uma réplica biológica (n = 8).
Como vimos, uma boa técnica de pipetagem é essencial para alcançar resultados confiáveis e reprodutíveis em cultura de células 3D, e a falha nos processos de pipetagem é o principal fator que resulta em variabilidade da concentração do hidrogel, concentração celular e volume total no poço, para atingir coeficientes de variação baixos, é importante o uso de protocolos padronizados usando pipetas eletrônicas Picus® da Sartorius.
Para saber mais sobre métodos de cultura de células 3D:
Caliari, S., Burdick, J. A practical guide to hydrogels for cell culture. Nat Methods 13, 405–414 (2016). https://doi.org/10.1038/nmeth.3839

 Notícias
Notícias


